発達障害克服への取組みと成果
画像から自閉症の原因を探る
2014年7月1日 | カテゴリー/原因解明と治療法の開発
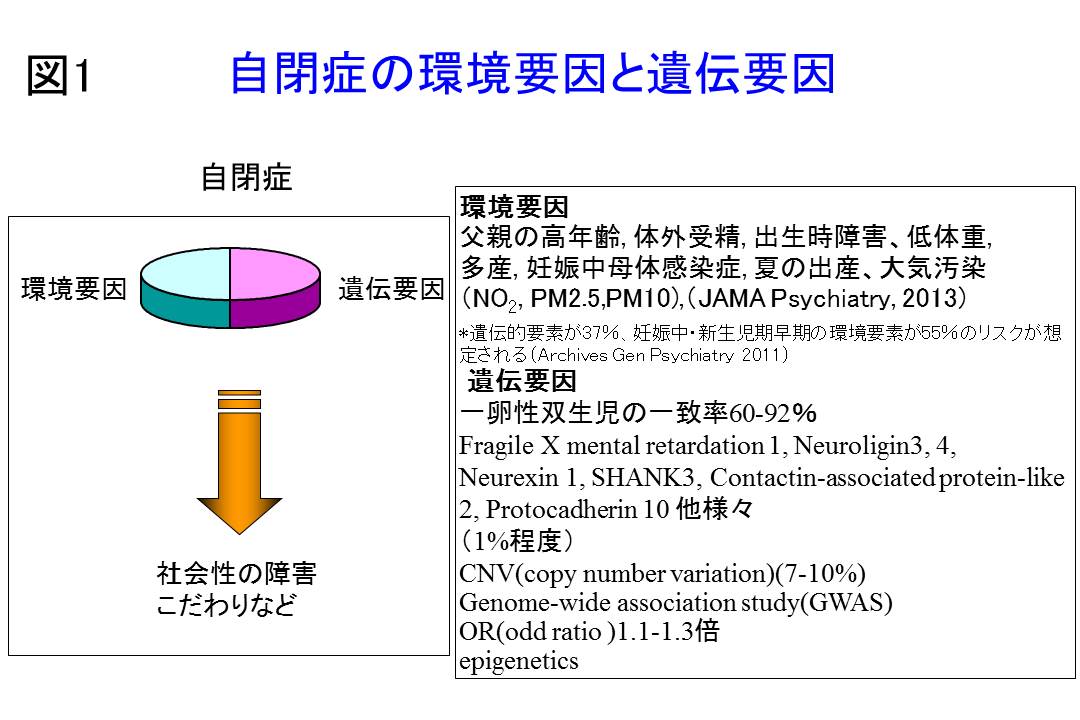
自閉症発症の遺伝要因と環境要因について
自閉症は高血圧症、糖尿病などと同様で遺伝要因、胎生期での環境要因他、多くの事柄が関与する多因子疾患であることが定説となりました。自閉症は家族性の疾患や遺伝病ではありません。自閉症の発症は、約400個の遺伝子が関与し、人によって遺伝子の組み合わせが違い、特徴としては孤発例(家系の中に他に自閉症の方がいない)が多いと報告されています。図1で示しますように遺伝要因としては、様々な遺伝子が報告されています。
自閉症では、一卵性双生児の一致率が70-90%であり、従来遺伝的な関与が強いと考えられ、様々な自閉症関連遺伝子が報告されています1)。環境要因としても、様々な報告があり、最近は遺伝要因よりは環境要因の方が強いと報告され、新しい双生児研究よると自閉症の環境要因は55%と報告されました2)。環境要因としては、父親の高年齢、体外受精、出生時低体重、多産、妊娠中母体感染症などが報告され、最近では妊娠中や、生まれてから1年における大気汚染のPM2.5、PM10が自閉症と関連しているとの報告があります3)。(図1)
自閉症の画像研究について
脳科学の最近の進歩、検査機器の向上に伴い、自閉症に関する精神医学研究は日々進んでいます。様々な研究手法の中で、画像研究は直接脳の様子がわかることより注目されています。自閉症の画像研究に関しては、MRI (magnetic resonance imaging)、SPECT (single-photon emission tomography)、PET (positron emission tomography) を用いた数多くの研究が報告されています。また研究内容についても、神経伝達系の異常、脳の構造や大きさの異常、表情認知や追視の異常など様々な報告があります。私どもはその中で、PETを用いた自閉症研究を行っています4)-6)。PETは脳内における神経伝達機能の測定が可能です。ドパミン系、セロトニン系、アセチルコリン系、ベンゾジアゼピン系、ヒスタミン系など様々なトレーサー(分子プローブ)があり、それらを用いることで脳内の生化学的過程の画像化や定量的解析ができます。
PETについて
PETについて少し解説をします。PETとはPositron Emission Tomography (陽電子放出型断層撮影) の略称で、陽電子(ポジトロン)の体内分布を画像化する撮影法です。ポジトロンは、電子と同じ質量を持ち、電子とは正反対のプラスの電荷を持っています。PETは、サイクロトロン、薬剤合成標識装置、PET装置という一連のシステムによって支えられた統合技術であるとともに、工学、物理学、化学、薬学、医学知識の産物です。PETでは、生体内の生理的・生化学的情報をとらえることが可能です。さらに、生体内のいろいろな機能を調べることによって、病気の早期診断や治療後の経過を知ることができます。特に、脳疾患、心臓病、腫瘍に対しては、個々の機能的異常を正確かつ事前に見つけられるという点で優れた検査法です。我々のPET は頭部専用PETスキャナ (SHR12000、Hamamatsu Photonics KK、Hamamatsu、Japan) を用いました(図2)。
最近はPETによるがん検診が日本各地で行われており、PETの機械が普及しました。我々の用いたPETスキャンは、頭を入れるためだけの穴(ガントリー)があります。がん検診用だとこの穴は体が入るぐらい大きさですが、これは頭部用につくられた特別なPETで、穴が小さいので、ここに頭を入れると、センサーとの距離が近く精度の良い値を取ることができます。
セロトニン系に着目したPET研究
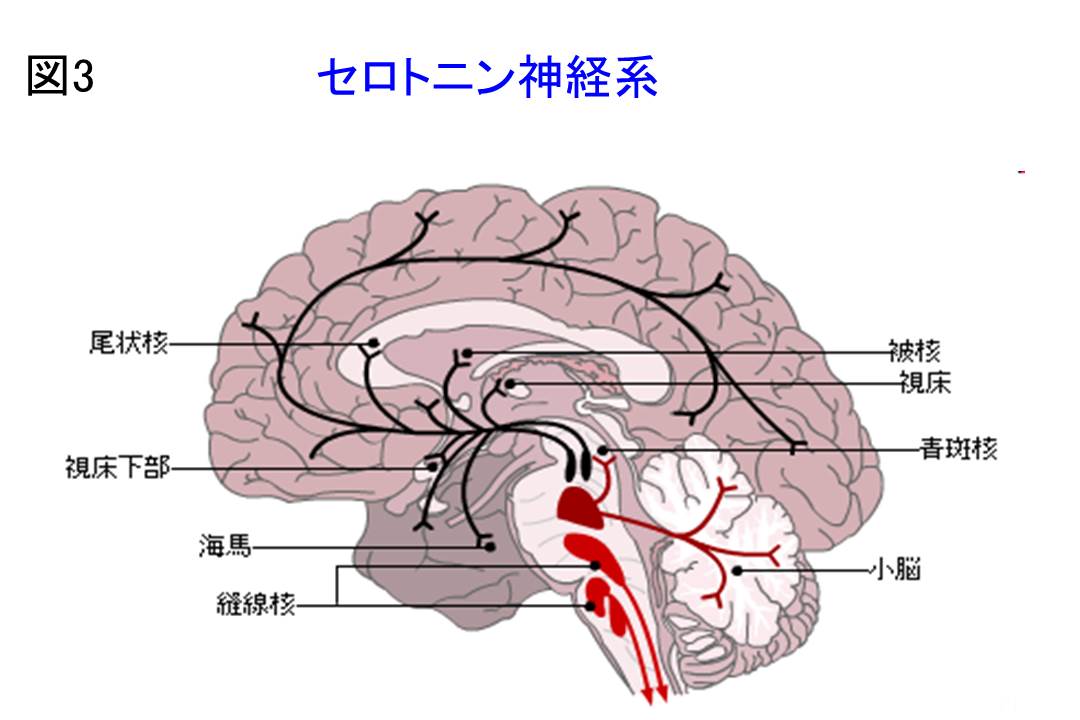
今回は自閉症とセロトニン・トランスポーターに関するPET研究を紹介します。神経伝達のプロセスには、神経伝達物質の生合成・貯蔵・放出、レセプターへの結合・代謝・再取り込みなど多くの機能が関与しています。したがって、神経伝達機能を対象としたPETの分子イメージングには、神経伝達物質の神経細胞内の合成酵素やシナプス間隙中に存在する分解酵素などの酵素、シナプス前膜や後膜に存在するレセプター、再取り込み部位やシナプス小胞膜に存在するトランスポーターなどが対象となります7)。自閉症においては様々な神経伝達系の研究が報告されています。自閉症の病態に関する最初の研究は、セロトニン系です(図3)。
1977年から自閉症の血液中や血小板においてセロトニン値の上昇が報告されました8),9)。さらに、セロトニンの前駆体であるトリプトファンの欠乏食を与えるとこだわり症状や強くなり、不安や不幸せ感が上昇すると報告されました10)。そしてうつ病の治療薬であるSSRI (selective serotonin reuptake inhibitor) の使用によって自閉症のこだわり症状や強迫症状に効果があるとの報告があります11)。さらにセロトニン系の重要な因子であるセロトニン・トランスポーターに関する自閉症研究では、セロトニン・トランスポーター遺伝子の制御部分であるプロモーター領域の機能に関連するポリモルフィズムのshort allele (S) とlong allele (L)と自閉症との相関が報告されました12)。そして、2歳から4歳の44人の男子の自閉症対象群の各脳部位の体積とこのポリモルフィズムとの相関について、short alleleはcortical やfrontalの部位の灰白質の体積の10-16%に関連していました13)。さらに自閉症のゲノムスキャン解析を行なうと、セロトニン・トランスポーターのある17番染色体の部位に有意差があると報告されました14)。Chuganiらは15)-17)、脳におけるセロトニン合成能についてmethyl-L-tryptophanをトレーサとして用いたPET研究を行いました。自閉症の子ども30人 (2歳-15歳) とてんかんの子ども16人 (3ヶ月-13歳) を比較しました (正常の子どもは倫理的にPETが施行できないゆえ、てんかん群を正常群としています)。正常群では5歳までは、大人の200%以上のセロトニン合成能があり、その後次第に大人のレベルまで減少します。一方自閉症の子ども群においては、セロトニン合成能は2歳から15歳まで次第に上昇し大人の150%までしかならなかった。子どもの早い段階ではセロトニン合成能が正常群では高いが、自閉症群では何らかの障害を受けセロトニン合成能が低いと考えられます。このように自閉症児においては、成長過程においてセロトニン系メカニズムの障害が派生していることが推測されます。そしてSPECTによってセロトニン・トランスポーターの脳内分布が報告されています18)。使用したトレーサは123I nor-β-CITです。15人の自閉症の子どもと10人の正常対象群を比較したところmedial frontal cortexにおいてセロトニン・トランスポーターが低下していました。medial frontal cortexはこころの理論や、他人の考えや意思を理解するための重要な領域です。現在のところセロトニン神経系としてPETで測定できるのは、セロトニン・トランスポーター、5-HT1Aレセプター、5-HT2Aレセプターです。そこで我々はPETを用いて、セロトニン神経終末の構成要素であるセロトニン・トランスポーター脳内密度を定量しました。そして、自閉症のセロトニン神経系の状態を健常者と比較検討し、同疾患のセロトニン神経系の異常の有無を検索し、臨床症状との関連を研究しました19)。対象は自閉症20名 (全て男性;年齢:18-26歳)、および、性別、年齢の合致した健康健常者20名 (全て男性) です。ADI-R(Autism Diagnostic Interview-Revised)で自閉症の診断基準を満たし、WAISで総合IQが70以上です。自閉症のうち、他の精神疾患、脳の器質的異常を有する者、重篤な身体疾患(甲状腺機能障害、免疫疾患などを含む)、および、精神科薬物療法を受けた既往のある者は除外しました。これは、Structured Clinical Interview for the Diagnostic and Statistical Manual IV (SCID) に準じた問診を本人およびその家族に施行することにより決定しました。
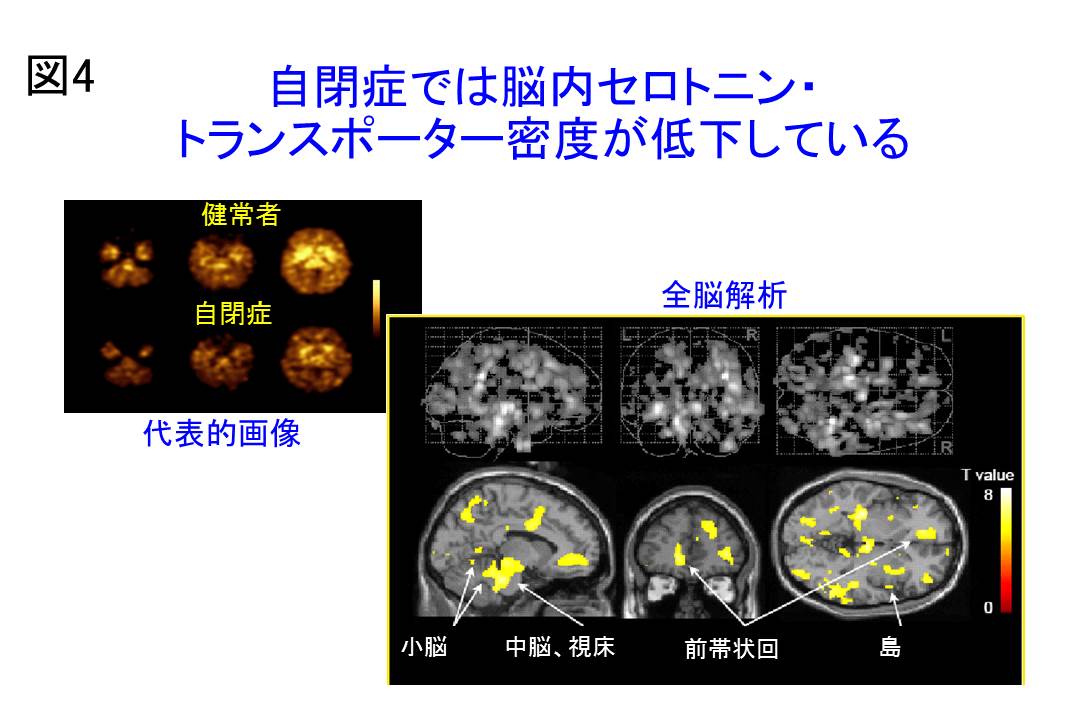
PET には頭部専用PETスキャナ (SHR12000、Hamamatsu Photonics KK、Hamamatsu、Japan) を用いました。トレーサにはセロトニン・トランスポーターへの選択性の高い[11C](+)McN5652を用いました。臨床スコアとの相関について、自閉症に対する臨床症状は、社会性障害についてはFaux Pas Test [fou-pa:]を用いました。これは成人の自閉症のこころの理論の障害を計るテストとして考案されたものです (合計20問) 20)。こだわり症状に対しては強迫症状スケールであるYale-Brown Obsessive Compulsive Scale (Y-BOCS)を用いました。それらの臨床スコアとPET画像との相関を検討しました。結果は自閉症では健常者と比較して,大脳皮質全般,基底核,中脳,小脳に渡る広範囲の部位でセロトニン・トランスポーターが有意に低下していました(図4)。
Faux Pas Testで測定した自閉症のこころの理論の障害の程度と帯状回におけるセロトニン・トランスポーターの低下は相関していました(図5)。
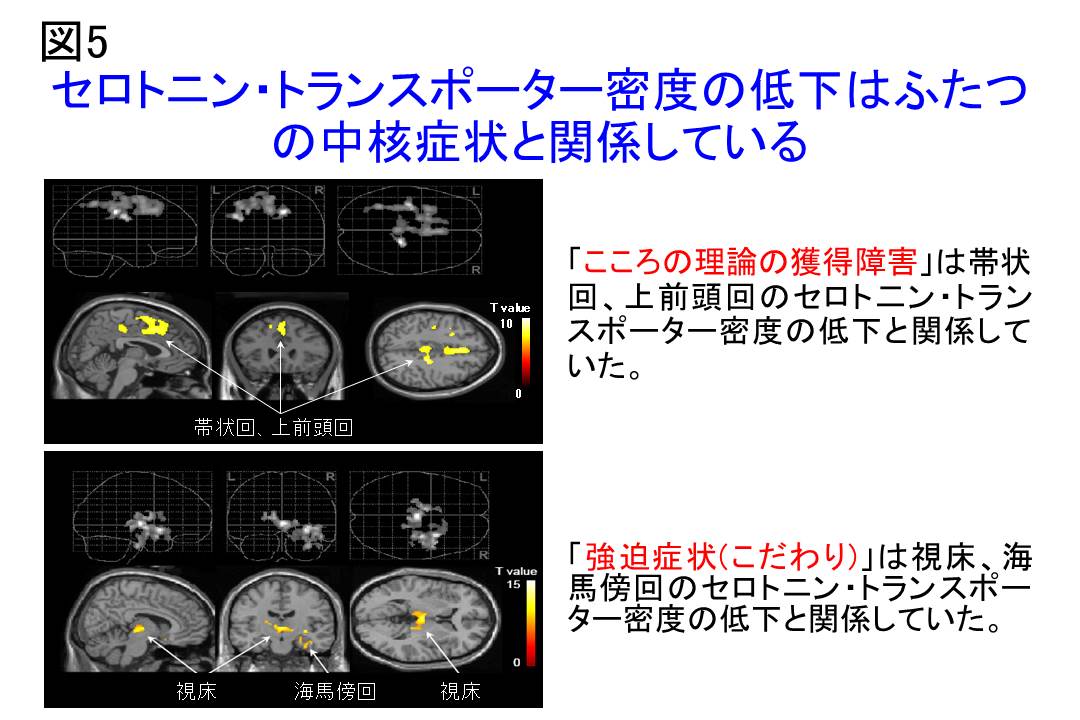
我々は自閉症群が、健常者群に比し、大脳皮質全般,基底核,中脳,小脳などの脳部位でセロトニン・トランスポーターが有意に低下していることを見いだしました。自閉症に関して、重要な所見は、血液におけるセロトニンの上昇です。これは、セロトニン・トランスポーターが形成される、発達段階のときにセロトニン終末の脱落によって引き起こされると考えられています21),22)。おそらく脳においても、同様であろうと推測されています。それゆえ、脳の様々な部位でセロトニン・トランスポーターが低下は、発達段階においてセロトニン神経伝達系が変化していることに起因すると推測されます。本研究では、Faux Pas Testで測定した自閉症のこころの理論の障害の程度と帯状回におけるセロトニン・トランスポーターの低下は相関していました。こころの理論と帯状回の関連については、先行研究により支持されているところであります。例えば、rCBF (regional cerebral blood flow)をみるSPECT研究や23)、18F-deoxyglucoseを用いたPET研究24)ではCARS (Childhood Autism Rating Scale) やADI-Rでスコア化した社会性の障害、こころの理論に関与していると考えられるコミュニケーション障害が、帯状回の血流量や代謝と関与していると報告されています。これらのことから帯状回はこころの理論を制御する重要なメカニズムであることが示唆されました。次に自閉症のこだわりの指標としての強迫症状とセロトニン神経系の関係については、セロトニン・トランスポーターの低下と強迫症状の強度との有意な相関が認められました。自閉症の主な臨床症状の1つとして強迫的で繰り返される行動があげられ、具体的には、行動、興味および活動が限定され、反復的で常同的で 強度で、異常なほど、1つまたはいくつかの興味だけに熱中することや特定の無意味な習慣や儀式にかたくなにこだわることがあげられます。強迫症状の責任部位について、自閉症の各脳部位でのセロトニン・トランスポーターの低下と強迫症状の疾患内相関を検討したところ視床において相関が認められ、視床においてセロトニン神経機能が低いほど強迫症状が強いことが明らかになりました (図5) 。視床は強迫性障害の治療薬であるSSRI(セロトニン選択的再取り込み阻害薬)が集積する重要な部位です。自閉症において強迫症状に対するSSRIの効果については有効な方と有効でない方があります。強迫症状の責任部位が複数あると考えられるが、SSRIは主に視床に分布されるので、強迫症状に対するSSRIの薬物効果には限界があると推察されます。
今回の結果により、自閉症のセロトニン機能の障害は、出生後から始まっていると推測されます。ゆえに、生後の脳の発達時期にセロトニン神経伝達を正常化するような治療法開発の参考になると考えられます。そして療育的観点からは療育により別の経路、側副路でセロトニン機能障害を補う考え方があります。例えば、脳梗塞の方がリハビリをするように、自閉症の方は療育を受けながら別の神経経路で能力を補っていく必要があります。療育指導は、指導する側の固定観念にとらわれずに工夫して、個々にあった療育指導の方策を築き上げる必要あります。今後まだ研究や療育方法の開発が必要です。
我々は自閉症のPET研究を各種行い自閉症の脳内での障害を、PET脳画像研究によって明らかにすることができました。自閉症は近年ではその近縁状態も含めれば100人に1人とも言われる発現頻度の高い障害ですが、身体障害のような「見える障害」ではないために、社会的な理解が遅れ、今まで、親の育て方が悪い、あるいは本人のわがままだ等といった偏見に満ちた間違った理解をされていましたが、今回の研究においても、自閉症が間違いなく脳機能の障害によって生じていることが明らかになり、自閉症の社会的理解を推し進めることにつながると考えられます。なお、この研究は、NPO法人アスペ・エルデの会の成人当事者が積極的に研究への協力を行い、継続的な自助活動やそれらを背景とする長期にわたる発達支援によって可能になりました。
文献
1) Folstein SE, Rosen-Sheidley B. Genetics of autism: complex aetiology for a heterogeneous disorder. Nat Rev Genet. 2001;2:943-955.
2) Hallmayer J, Cleveland S, Torres A, Phillips J, Cohen B, Torigoe T, Miller J, Fedele A, Collins J, Smith K, Lotspeich L, Croen LA, Ozonoff S, Lajonchere C, Grether JK, Risch N. Genetic heritability and shared environmental factors among twin pairs with autism. Arch Gen Psychiatry. 2011 ;68:1095-102.
3) Volk HE, Lurmann F, Penfold B, Hertz-Picciotto I, McConnell R. Traffic-related air pollution, particulate matter, and autism. JAMA Psychiatry. 2013;70:71-77.
4) Suzuki K, Sugihara G, Ouchi Y, Nakamura K, Futatsubashi M, Takebayashi K, Yoshihara Y, Omata K, Matsumoto K, Tsuchiya KJ, Iwata Y, Tsujii M, Sugiyama T, Mori N. Microglial activation in young adults with autism spectrum disorder. JAMA Psychiatry. 2013;70:49-58.
5) Nakamura K, Sekine Y, Ouchi Y, Tsujii M, Yoshikawa E, Futatsubashi M, Tsuchiya KJ, Sugihara G, Iwata Y, Suzuki K, Matsuzaki H, Suda S, Sugiyama T, Takei N, Mori N. Brain serotonin and dopamine transporter bindings in adults with high-functioning autism. Arch Gen Psychiatry. 2010;67:59-68.
6) Suzuki K, Sugihara G, Ouchi Y, Nakamura K, Tsujii M, Futatsubashi M, Iwata Y, Tsuchiya KJ, Matsumoto K, Takebayashi K, Wakuda T, Yoshihara Y, Suda S, Kikuchi M, Takei N, Sugiyama T, Irie T, Mori N. Reduced acetylcholinesterase activity in the fusiform gyrus in adults with autism spectrum disorders. Arch Gen Psychiatry. 2011;68:306-313.
7) 佐治英朗. イメージングプローべの開発と応用. Drug Delivery System 2008; 23-1: 24-32.
8) Hanley HG, Stahl SM, Freedman DX. Hyperserotonemia and amine metabolites in autistic and retarded children. Arch Gen Psychiatry 1977; 34: 521-531.
9) Ciaranello RD. Hyperserotonemia and early infantile autism. N Engl J Med 1982; 307: 181-183.
10) McDougle CJ, Naylor ST, Cohen DJ, et al. Effects of tryptophan depletion in drug-free adults with autistic disorder. Arch Gen Psychiatry 1996; 53: 993-1000.
11) McDougle CJ, Naylor S, Cohen DJ, et al. A double-blind, placebo-controlled study of fluvoxamine in adults with autistic disorder. Arch Gen Psychiatry 1996;53: 1001-1008.
12) Devlin B, Cook EH Jr, Coon H, et al. Autism and the serotonin transporter: the long and short of it. Mol Psychiatry 2005; 10: 1110-1116.
13) Wassink TH, Hazlett HC, Epping EA, et al. Cerebral cortical gray matter overgrowth and functional variation of the serotonin transporter gene in autism. Arch Gen Psychiatry 2007; 64: 709-717.
14) Yonan AL, Alarcon M, Cheng R, et al. A genomewide screen of 345 families for autism-susceptibility loci. Am J Hum Genet. 2003; 73:886-897.
15) Chugani DC, Muzik O, Behen M, et al. Developmental changes in brain serotonin synthesis capacity in autistic and nonautistic children. Ann Neurol. 1999; 45: 287-295.
16) Chugani DC, Muzik O, Rothermel R, et al. Altered serotonin synthesis in the dentatothalamocortical pathway in autistic boys. Ann Neurol. 1997; 42: 666-669.
17) Chandana SR, Behen ME, Juhasz C, et al. Significance of abnormalities in developmental trajectory and asymmetry of cortical serotonin synthesis in autism. Int J Dev Neurosci. 2005; 23: 171-182.
18) Makkonen I, Riikonen R, Kokki H, et al. Serotonin and dopamine transporter binding in children with autism determined by SPECT. Dev Med Child Neurol. 2008; 50: 593-597.
19) Nakamura K, Sekine Y, Ouchi Y et al. Brain serotonin and dopamine transporter bindings an adults with high-functioning autism. Arch Gen Psychiatry 2010;67: 59-68.
20) Baron-Cohen S, O’Riordan M, Stone V. et al. Recognition of faux pas by normally developing children and children with Asperger syndrome or high-functioning autism. J Autism Dev Disorder 1999;29: 407-418.
21) Cook EH Jr. Brief report: pathophysiology of autism: neurochemistry. J Autism Dev Disorder. 1996;26: 221-225.
22) Whitaker-Azmitia PM. Behavioral and cellular consequences of increasing serotonergic activity during brain development: arole in autism. Int J Dev Neurosci.2005; 23: 75-83.
23) Ohnishi T, Matsuda H, Hashimoto T, et al. Abnormal regional cerebral blood flow in childhood autism. Brain 2000; 123: 1838-1844.
24) Haznedar MM, Buchsbaum MS, Wei TC, et al. Limbic circuitry in patients with autism spectrum disorders studied with positron emission tomography and magnetic resonance imaging. Am J Psychiatry 2000; 157: 1994-2001.
![またはお近くの研究所へ [本部] Tel 06-6341-5545 / [浜松] Tel 053-456-057](https://kodomolove.org/wp/wp-content/themes/twentythirteen_child/common/images/pages/txt_contact01.gif)